4-1 原子结构和元素周期表
一、原子结构
$\\$
$$
\text{原子}
\left.
\begin{cases}
\text{原子核} \left.
\begin{cases}
\text{质子} & \text{相对质量约为1} \\
\text{中子} & \text{相对质量约为1}
\end{cases}
\right. & \text{其整数值相加得到质量数} \\
\text{电子}&\text{质量可忽略不计}
\end{cases}
\right.
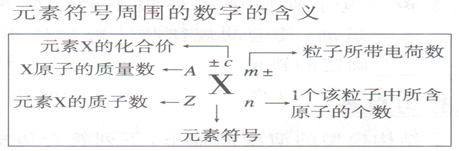
$$$量数 A = 质子数Z + 中子数N $ 质量数近似等于该原子的质量$\\$
质子(或中子)的相对质量 $\approx \frac{\text{一个质子或中子的质量}}{一个^{12}C原子质量的1/12}$ $\\$
同位素的近似相对原子质量在数值上等于该同位素原子的质量数(不能认为相对原子质量就是质量数)$\\$
元素的(精确)的相对原子质量是根据各种核素的相对原子质量和它们在原子总数中所占的百分比计算的平均值原子的表示方法: $^{\text{质量数} A}_{\text{质子数} Z}X$
$^{1}_{1}H$ 氢原子:质量数1;质子数1;中子数0;电子数1
$^{14}_{7}N$ 氮原子:质量数14;质子数7;中子数7;电子数7
原子结构模型的演变
| 原子结构模型的概念 | 科学家根据科学猜想和分析通过对原子结构形象描摹而建构的揭示原子本质认知模型 |
| 道尔顿模型 | 原子是构成物质的基本粒子,是坚实的,不可再分的实心球体 |
| 汤姆孙模型 | 原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,呈电中性 |
| 卢瑟福模型 | 原子中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在核周围沿着不同轨道运转。 |
| 玻尔原子模型 | 电子在原子核外空间的一定轨道上绕核做高速圆周运动 |
| 电子云模型 | 现代物质结构学说。电子在原子核外很小的空间内做高速运动,其运动规律与一般物体不同,没有确定的轨道 |
二、核外电子排布
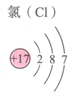
电子层:在多电子的原子中,把电子运动的能量不同的区域简化为不连续的壳层,称作电子层
电子层有7层,每个电子层最多容纳$2n^2$个电子($n=$电子层数)
| 电子层数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 字母代号 | K | L | M | N | O | P | Q |
| 每层最多能排电子数 | 2 | 8 | 18 | 32 | 32 | 18 | 8 |
| 离原子核远近 | 由远到近 | ||||||
| 电子能量高低 | 由低到高 |
- $\\$
| 原子结构示意图 | 离子结构示意图 | ||
|---|---|---|---|
| 钠原子 $Na$ | 氯原子 $Cl$ | 钠离子 $Na^+$ | 氯离子 $Cl^-$ |
 |
 |
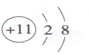 |
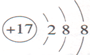 |
- $\\$
| “10电子”粒子 | “18电子”粒子 | ||||
| 分子 | 离子 | 分子 | 离子 | ||
| 一核10电子 | $Ne$ | $N^{3-}, O2^- ,F^-,\\ Na^+, Mg^{2+}, Al^{3+}$ | 一核18电子 | $Ar$ | $K^+, Ca^{2+} \\ Cl^-, S^{2-}$ |
| 两核10电子 | $HF$ | $OH^-$ | 两核18电子 | $F_2, HCl$ | $HS^-$ |
| 三核10电子 | $H_2O$ | $NH^{2-}$ | 三核18电子 | $H_2S$ | |
| 四核10电子 | $NH_3$ | $H_3O^+$ | 四核18电子 | $PH_3$ $H_2O_2$ | |
| 五核10电子 | $CH_4$ | $NH_4^+$ | 五核18电子 | $SiH_4$ | |
| 核外电子总数及质子数均相同的离子 | $Na^+, H_3O^+, NH_4^+, \\ F^-, OH^-, NH_2^-$ |
三、元素,核素,同位素,同素异形体
| 元素 | 核素 | 同位素 | 同素异形体 |
| 质子数相同的同一类原子 | 质子数相同,中子数不同的原子 | 质子数相同,中子数不同的原子之间的相互称谓 | 同种元素形成的不同单质之间的相互称谓 |
| 同种元素组成的不同原子 | 核素之间的相互称呼 | 单质之间的相互称呼 | |
| $H$氢元素,$C$碳元素 | $_1^1H , _1^2H , _1^3H $是三种核素 | $_1^1H , _1^2H , _1^3H $互为同位素 | $O_2$与$O_3$ 互为同素异形体 |
$_1^2H , _1^3H $用于制氢弹
$^{14}_{6}C$用于考古工作中测定文物年代
$_{92}^{235}U$用于原子弹,核发电站
放射性同位素可用于育种,治疗癌症和肿瘤
四、元素周期表
1869年,俄国化学家门捷列夫将已知的元素按相对原子质量由小到大依次排列,将化学性质相似的元素放在同一纵列,编出第一张元素周期表,后来,改为按原子的核电荷数顺序排列,形成现在的元素周期表
元素周期表编排原则
原子序数:按元素的在周期表中顺序给元素编号。原子序数=核电荷数=质子数=核外电子数
横行(周期):把电子层数相同的元素,按原子序数递增的顺序由左到右排列。
共7周期,1~3为短周期,4~7为长周期纵行(族):把不同横行中最外层电子数相同的的元素,按电子层数递增的顺序由上向下排列
共18竖行,16族。
五、元素性质与原子结构
- 碱金属元素
- 碱金属原子的性质
锂 钠 钾 铷 铯 Li Na K Rb Cs 最外层电子数 1 1 1 1 1 电子层数 2 3 4 5 6
$\longrightarrow$原子半径逐渐变大/ 原子核对最外层电子引力逐渐变小/密度逐渐增大,溶沸点逐渐降低
$\longrightarrow$失电子的能力逐渐增强,单质还原性和金属性逐渐增强 ,对应的碱其碱性逐渐增强
- 碱金属单质物理化学性质
锂 Li 钠 Na 钾 K 铷 Rb 铯 Cs 颜色状态 银白色有金属光泽的固体,铯略带金黄色,柔软,锂的密度比煤油小 与$O_2$反应 没有Na剧烈 剧烈燃烧黄色火焰 燃烧更剧烈紫色火焰 比K剧烈生成复杂氧化物 $4Li+O_2\stackrel{△}{=}2Li_2O$ $2Na+O_2\stackrel{△}{=}Na_2O_2$ $K+O_2\stackrel{△}{=}KO_2$ 与$H_2O$(或酸)反应生成$H_2$ 反应较慢生成$H_2$ 反应剧烈熔成小球,浮于水面,四处游动,发出嘶嘶的声音 反应剧烈熔成小球,浮于水面,四处游动,轻微爆炸声 遇水立即燃烧,爆炸,生成$H_2$ $2Na+H_2O=2NaOH+H_2↑$ $2K+H_2O=2KOH+H_2↑$ 最高价氧化物对应的水化物都是强碱 碱性强弱:$LiOH \lt NaOH \lt KOH \lt RbOH \lt CsOH$ 密度由小$\longrightarrow$大;熔沸点由大$\longrightarrow$小;还原性金属性由弱$\longrightarrow$强;与氧气和水反应剧烈程度由弱$\longrightarrow$强 Li密度小于煤油,保存在液体石蜡中; Na和K保存在煤油中;液态钠用作核反应堆的热介质
- 卤族元素
| 氟 | 氯 | 溴 | 碘 |
| F | Cl | Br | I |
最外层电子数都是7 ,化学性质相似
$\longrightarrow$原子半径逐渐变大/ 原子核对最外层电子引力逐渐变小/密度逐渐增大,溶沸点逐渐降低
$\longrightarrow$得电子的能力逐渐减弱,单质氧化性性逐渐减弱
| 其单质的化学式 | $F_2$ | $Cl_2$ | $Br_2$ | $I_2$ |
| 颜色 | 淡黄绿色 | 黄绿色 | 深红棕色 | 紫黑色 |
| 状态 | 气体 | 气体 | 液体 | 固体 |
$\longrightarrow$密度由小$\rightarrow$大,熔沸点由低$\rightarrow$高

